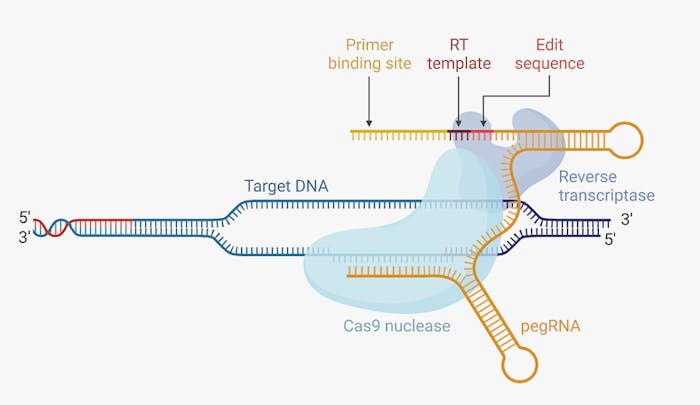
Was ist das CRISPR/Cas-9 System?
CRISPR/Cas steht für «Clustered regularly interspaced short palindromic repeats/ CRISPR-associated». Dabei handelt es sich um spezifische Gensequenzen im Genom, welche vom CRISPR-assoziierten Protein erkannt werden. CRISPR-Sequenzen wurden erstmals im Jahr 1987 in Bakterien entdeckt, wobei ihre Funktion noch unbekannt war. Später fand man heraus, dass es sich dabei um eine Art Immunsystem von Bakterien handelt, das dazu dient, Viren abzuwehren. Die Wissenschaftlerinnen Jennifer Doudna und Emmanuelle Charpentier zeigten 2012, wie man dieses System in der Gentechnik anwenden kann, um spezifisch Gensequenzen zu verändern. Für ihre Entdeckungen erhielten sie im Jahre 2020 den Nobelpreis für Chemie. Der Neurowissenschaftler Feng Zhang vom MIT in Boston schliesslich machte das System auf Säugetierzellen und auf Versuchstiere anwendbar.
Wie funktioniert CRISPR?
Das CRISPR-Cas9-System funktioniert wie eine molekulare «Schere», die es ermöglicht, gezielt DNA an bestimmten Stellen zu schneiden. Es besteht aus zwei Hauptbestandteilen: einem RNA-Molekül, das eine spezifische DNA-Sequenz erkennt, und dem Cas-Enzym, das den DNA-Strang an der markierten Stelle schneidet. Nach dem Schnitt kann die Zelle die beschädigte DNA reparieren und dabei Fehler einbauen, die Gene deaktivieren, oder gezielt neue Gensequenzen einfügen.
Wie und wofür wird es angewendet?
Das Genom von Bakterien, Säugerzellen oder Versuchstieren kann anhand von CRISPR-Cas gezielt und präzise verändert werden. Gegenüber früheren Methoden erlaubt die CRISPR-Cas-Methode eine viel gezieltere, effizientere und kostengünstigere Genom-Editierung. Beispielsweise kann eine defekte Gensequenz korrigiert werden. In der Grundlagenforschung kann ein Gen auch spezifisch inaktiviert werden, zum Beispiel, um anhand von Zellkulturen eine bestimmte Krankheit zu modellieren. Beispielsweise konnte anhand von CRISPR-Cas im Mausmodell eine metabolische Leberkrankheit behandelt werden (1).
Ethische Perspektiven
Der chinesische Forscher He Jiankui sorgte 2019 für einen Aufschrei, als er seine Arbeit präsentierte: Er behauptete, dass er im Reagenzglas menschliche Embryonen so verändert hatte, dass ihnen der für eine HIV-Infektion essenzielle Rezeptor fehlte und sie somit immun gegen eine HIV-Infektion wären. He hatte Keimzellen genetisch verändert, diese dann künstlich befruchtet und in die Gebärmutter eingepflanzt. Dies bedeutet, dass die so geborenen Kinder ein verändertes Erbgut haben, welches sie wiederum weitervererben können. Es gab jedoch zu der Zeit kein Einverständnis eines Ethikkomittees, solche Versuche durchzuführen, noch waren die dazu verwendeten Forschungsgelder dafür vorgesehen. Zu ungewiss waren die Nebenwirkungen einer solchen Behandlung. He wurde schliesslich wegen illegaler medizinischer Praktiken zu 3 Jahren Gefängnis verurteilt (2).
Daraufhin wurden international Rufe nach einem Moratorium laut. Heute gelten für die Anwendung von CRISPR-Cas am Menschen in vielen Ländern strenge gesetzliche und ethische Regelungen. In der europäischen Union beispielsweise ist die Anwendung von Genom-Editierung an menschlichen Keimbahnzellen, die an Nachkommen weitergegeben werden können, weitgehend verboten.
Eine andere Kontroverse dreht sich um die Frage, wem eine Entdeckung oder Erfindung gehört bzw. wer die kommerziellen Rechte darauf besitzt. Ein erbitterter Patentstreit entbrannte zwischen Doudna und Zhang, welcher sich bis heute über Jahre herauszieht. Das US Patentamt hat dabei gegen die Nobelpreisträger entschieden und das Patent Zhang zugesprochen (3). Anders jedoch in Europa: hier wurden Doudna und Charpentier als Patentinhaberinnen bestätigt (4).
Chancen und Herausforderungen
Die Chancen, welche Genom-Editierung bieten, sind unbestritten. Sie beschleunigt und vereinfacht Grundlagenforschung markant und bietet vorher nie dagewesene Möglichkeiten. In der Klinik konnten zum Beispiel dank CRISPR-Cas- Erfolge in der Behandlung der Leberschen Kongenitalen Amaurose, einer Augenkrankheit, verzeichnet werden. Ausserdem gibt es vielversprechende Resultate aus klinischen Studien zu CRISPR-Gentherapien der Blutkrankheiten Sichelzellanämie und Beta-Thalassämie (5).
Jedoch gibt es noch einige Herausforderungen. Das CRISPR-Cas System kann nämlich auch unerwünschte Änderungen im Genom erzeugen, sogenannte Off-target-Effekte. Damit die Sicherheit von CRISPR-Cas-gestützen Therapien gewährleistet ist, müssen deshalb rigorose Prüfungsmassnahmen erfolgen.
Da es sich bei Genom-Editierung um ein Thema handelt, das sowohl wissenschaftliche wie auch ethische und gesellschaftliche Fragen aufwirft, ist eine interdisziplinäre Zusammenarbeit unabdingbar. Schweizer Forscher sind massgeblich daran beteiligt, Rahmenbedingungen für solche Zusammenarbeiten zu schaffen (6).
Generell besteht ein Konsens, dass die medizinischen Benefits der Gen-Editierung überwiegen, dass jedoch mehr Forschung und regulatorische Standards nötig sind (7).
Quellen
1. Villiger L, Grisch-Chan HM, Lindsay H, Ringnalda F, Pogliano CB, Allegri G, u. a. Treatment of a metabolic liver disease by in vivo genome base editing in adult mice. Nat Med. Oktober 2018;24(10):1519–25.
2. Chinese scientist who produced genetically altered babies sentenced to 3 years in jail [Internet]. [zitiert 14. Mai 2025]. Verfügbar unter: https://www.science.org/content/article/chinese-scientist-who-produced-genetically-altered-babies-sentenced-3-years-jail
3. CRISPR's Nobel Prize winners defeated in key patent claim for genome editor [Internet]. [zitiert 14. Mai 2025]. Verfügbar unter: https://www.science.org/content/article/crispr-s-nobel-prize-winners-defeated-key-patent-claim-genome-editor
4. transGEN [Internet]. [zitiert 14. Mai 2025]. Streit um CRISPR/Cas-Patente: Die unendliche Geschichte. Verfügbar unter: https://www.transgen.de/recht/2721.crispr-streit-patent.html
5. Zhang S, Wang Y, Mao D, Wang Y, Zhang H, Pan Y, u. a. Current trends of clinical trials involving CRISPR/Cas systems. Front Med [Internet]. 10. November 2023 [zitiert 14. Mai 2025];10. Verfügbar unter: https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.2023.1292452/full
6. Kandlbinder A, Peter-Spiess MH, Leeners B, Mollaysa A, Cavazza T, Meier A, u. a. Strategies for Interdisciplinary Human Gene Editing Research: Insights from a Swiss Project. CRISPR J. April 2025;8(2):79–88.
7. Joseph AM, Karas M, Ramadan Y, Joubran E, Jacobs RJ. Ethical Perspectives of Therapeutic Human Genome Editing From Multiple and Diverse Viewpoints: A Scoping Review. Cureus. 14(11):e31927.